TORBEN INGEMANN PETERSEN, EINAR PAHLE, THORBJØRN SOMMER y THOMAS ZILLING
Departamento De Cirugía, Aarhus Universidad Hospital, Aarhus, Dinamarca
Abstracto.Antecedentes: Solo hay pocos informes sobre gastrectomía total mediante un enfoque quirúrgico laparoscópico. Una explicación es el miedo a las complicaciones debidas a la dehiscencia anastomótica en La anastomosis esofagoyejunal que se sabe que conlleva una alta morbilidad y mortalidad. La Introducción de grapadoras ha contribuido a hacer que la anastomosis sea más segura y fácil de realizar y ha facilitado una cirugía laparoscópica más avanzada. En cirugía abierta, la mayoría de Los cirujanos utilizan una grapadora circular para la anastomosis esofagoyejunal o una técnica suturada a mano. Ambas técnicas son difíciles de usar en cirugía laparoscópica, especialmente si el esófago es estrecho. Para facilitar la creación de anastomosis esofagoyejunal, hemos adoptado una técnica con una anastomosis lineal grapada. Nuestro método se basa en una técnica de grapado en la que el esófago se divide por encima de la CARDIA gástrica seguida de una esofagoyejunostomía realizada con la nueva GIA-60 Endo de Covidien.™Grapadora ultra universal. La abertura residual se cierra con una sutura reabsorbible 3-0. Pacientes y métodos: De junio de 2009 a mayo de 2012, y 16 mujeres 14 hombres (mediana de edad = 66 años, rango = 39-84 años) se sometieron a gastrectomía total laparoscópica debido a cáncer gástrico. Resultados: Un paciente murió durante la estancia hospitalaria; correspondiente a una mortalidad postoperatoria de 3,3%. Se produjeron fugas en la anastomosis esofagoyejunal en tres pacientes (10%). Dos de los pacientes con fugas en la anastomosis esofagoyejunal tuvieron una fuga adicional de bulbo duodenal, que podría haber causado dehiscencia anastomótica. Los pacientes tuvieron una estancia hospitalaria posoperatoria media de seis días (rango = 3 a 156 días). Seis pacientes tuvieron una reoperación debido a complicaciones, incluida una aplicación de stent endoscópico en la anastomosis. Conclusión: Aunque una tasa de fuga de 10% puede considerarse alta, este estudio describe un método simple para realizar esofagoyejunostomía después de la gastrectomía mediante un enfoque laparoscópico independientemente del ancho del esófago. Este estudio también muestra que la gastrectomía laparoscópica se puede realizar en etapas más avanzadas del cáncer gástrico.
Correspondencia A:Torben Ingemann Petersen, MD, Departamento de Gastroenterología Quirúrgica L, Hospital Universitario de Aarhus, Nørrebrogade 44, DK 8000 Åarhus C, Dinamarca. Tel: + 45 78463889,
Fax: + 45 78462840 Correo electrónico: torbpete@rm.dk
Clave Palabras: Gastrectomía total, cáncer gástrico, anastomosis esofagoyejunal, dispositivos de grapado, técnica quirúrgica mínimamente invasiva.
0250-7005/2013 $2,00 +.40
Desde el primer informe en 1994 de KitanoEt al. De la gastrectomía distal asistida por laparoscopia para el cáncer gástrico (1), se han notificado varios casos, principalmente realizados en Japón y Corea. A pesar del aumento exponencial por año en el número de procedimientos laparoscópicos realizados (2), su aceptación en comparación con el procedimiento abierto sigue siendo controvertida. A pesar de la creciente experiencia y actividad laparoscópica, La gastrectomía laparoscópica sigue siendo un procedimiento en investigación, reservado casi exclusivamente para el cáncer gástrico temprano y, para su viabilidad técnica, realizado principalmente como resección gástrica distal laparoscópica (3). El enfoque laparoscópico para los cánceres gástricos más avanzados aún debe investigarse más a fondo y el procedimiento aún debe adquirir una aceptación más amplia, incluso entre los laparoscopistas expertos y experimentados. La esofagoyejunostomía no es fácil de realizar, especialmente si el esófago es estrecho. En cirugía abierta, a menudo se usa una grapadora circular o una técnica suturada a mano. Estas técnicas no son fáciles de usar en la laparoscopia, a pesar de que hay un nuevo dispositivo, OrVil™(Covidien, Mansfield, MA 02048, EE. UU.), Donde el cartucho de La grapadora circular está conectado a un tubo gástrico para facilitar la intubación del esfago a través de la boca del paciente. Además de los problemas técnicos involucrados en la esfagojejunostomía, hay una discusión sobre la adecuación oncológica: ¿Es posible obtener una resección R0 y ganar al menos el mismo número alto de ganglios linfáticos resecados que I¿N cirugía abierta? (4) . En segundo lugar, aunque algunos ensayos clínicos aleatorizados compararon laparoscópicosVersus Gastrectomía abierta, quedan por llevar a cabo ensayos aleatorios prospectivos a gran escala con datos de supervivencia a largo plazo (5, 6). Finalmente, el enfoque laparoscópico es complejo e implica una larga curva de aprendizaje (2, 7). Tratar de implementar el procedimiento y adquirir la técnica requiere mucho tiempo y es costoso, sobre todo en el manejo de la mayor ocurrencia de complicaciones en la fase de aprendizaje. En este estudio, presentamos los resultados de nuestra serie de gastrectomía total laparoscópica consecutiva donde la anastomosis se aplica con un dispositivo de grapado lineal conocido por crear una anastomosis grapada significativamente más ancha en comparación con el dispositivo circular (8).
La recopilación de datos de pacientes fue aceptada por la Autoridad Nacional de Salud de Dinamarca. Entre junio de 2009 y mayo de 2012, 30 pacientes con un tumor gástrico probado por biopsia se sometieron a una gastrectomía total laparoscópica en nuestro departamento. Veintiocho pacientes tenían un carcinoma gástrico probado por biopsia y dos pacientes tenían cáncer metastásico en el estómago: una paciente con cáncer de mama previo y una paciente con cáncer escamoso previo en la región orofaringial, ambos con metástasis gástrica. Los tumores se localizaron en el tercio superior del estómago en cuatro pacientes, en el tercio medio en 10 pacientes y en el tercio inferior del estómago en 12 pacientes. Cuatro pacientes tenían lienitis plástica. Todos los pacientes se sometieron a una evaluación extensa de metástasis remota que, de ser positiva, excluyó al paciente de la operación. La evaluación preoperatoria incluyó gastroscopia con biopsia del tumor, laparoscopia y ecografía asistida por laparoscopia para descartar la diseminación a órganos adyacentes y siembra peritoneal, tomografía por emisión de positrones FDG y exploración por computadora. La operatividad incluyó electrocardiograma y, si es necesario, pruebas de función cardíaca y pulmonar. Los pacientes con estadio tumoral ≥ T2N0 fueron seleccionados para quimioterapia neoadyuvante (7). Las características de los pacientes se dan en la Tabla I.
![]() Tabla I.Char de los pacientesActerística.
Tabla I.Char de los pacientesActerística.
• Número de pacientes 30 (3 pacientes 2009, 9 pacientes 2010, 10 pacientes 2011, 8 pacientes 2012)
• Número de pacientes hombres/mujeres: 14/16
• Edad, mediana 66 (rango, 39-84) años
• Índice de masa corporal, mediana 23 (rango, 17-30)
• Puntuación ASA, número de pacientes: ASA I 9, ASA II 19, ASA III 2
Técnica quirúrgica.Bajo anestesia general, el paciente se colocó en posición supina con las piernas separadas y en una posición ligera con la cabeza hacia arriba. El cirujano se colocó en la posición francesa entre las piernas de los pacientes con el asistente de cámara en el lado derecho del paciente y el asistente más experimentado estaba en el lado izquierdo del paciente. La figura 1 muestra el procedimiento operativo paso a paso. El neumoperitoneo de CO2 se indujo con la ayuda de la cánula de Verres introducida en el hipocondrio izquierdo. Se colocaron dos puertos de 5 y dos de 12mm en línea justo por encima del ombligo y se colocó un retractor de hígado Natason en la parte superior del epigastrio para retraer el lóbulo del hígado izquierdo. Usando un laparoscopio oblicuo delantero de 30 °, se inspeccionó la cavidad peritoneal para detectar la siembra peritoneal y la metástasis hepática después de la quimioterapia preoperatoria. Manteniendo a un lado el lóbulo izquierdo del hígado, el ligamento gastrohepático se dividió usando tijeras activadas por ultrasonidos (UltraCision Harmonic Bistpel®; Ethicon Endo-Surgery, LLC, Guaynabo, Puerto Rico, EE. UU.) Siguiendo el Crus diafragmático derecho e izquierdo por encima y alrededor del esófago, donde el ligamento frenoesofágico y los nervios vagales se dividieron con la tijera armónica. Luego, el ligamento gastrocólico se dividió a lo largo del borde del colon transverso, incluido el episodio mayor en la muestra que se va a resecar. La disección se siguió a la derecha hasta el píloro donde se incluyeron en la resección los ganglios linfáticos infrapilóricos y suprapilóricos (estación de ganglio linfático 5 y 6, respectivamente). La arteria gástrica derecha se dividió en su origen de la arteria hepática común con la tijera armónica. La arteria y la vena gastroepiploicas derechas se dividen en su origen, donde la arteria gastroduodenal emerge detrás del píloro, ya sea con clips no reabsorbibles o tijeras armónicas. El espécimen a resecar se dividió a continuación en el bulbo duodenal justo debajo del píloro con Duet Endo-Gia de 60mm.™, Revista marrón, altura media (Covidien) . Ganglios linfáticos de la región anterior del hepatoduoEl ligamento denal y los ganglios linfáticos en la parte frontal de la arteria hepática común se resecaron a continuación (estación 8 y Estación 12 respectivamente). La vena coronaria y la arteria gástrica izquierda se dividieron con clips no reabsorbibles donde emergen en la base del tronco celíaco. Los ganglios linfáticos a lo largo del tronco celíaco y a lo largo de la arteria esplénica (estación 9 y Estación 11) se resecaron con la tijera armónica. Los ganglios linfáticos a lo largo de la curvatura gástrica mayor se incluyeron en la muestra resecada, incluidos los ganglios linfáticos en la curvatura gástrica mayor (estación 4a y 4b). La porción abdominal del esófago se movilizó lo suficiente como para resecar los ganglios linfáticos de la Estación 1 y la Estación 2. El esófago intraabdominal se transectó con 60mm de Endo-Gia.
Se preparó un bucle Roux-en-Y 30 cm por debajo del ligamento de Treitz y se anastomosóAnte Cólico Como una esofa-gojejunostomía de lado a la pared posterior de la grapadora cerró la parte intraabdominal del esófago con un Endo-Gia 60 de 60mm, altura media. Se utilizó una sutura 3-0 reabsorbible de funcionamiento no interrumpido para cerrar la abertura de acceso de la anastomosis grapada. Al final de la reconstrucción gastrointestinal, se probó la anastomosis para detectar fugas no expuestas con azul de metileno introducido en la anastomosis a través de un tubo transoral. Cincuenta centímetros distales de La anastomosis esofagoyejunal, La enteroanastomosis distal de lado a lado según Roux se realizó con una altura media de 60mm de Endo-Gia 60. La abertura de acceso se cerró con un 3-0 reabsorbible o una sutura V-lock. Cuando se realizaron las dos anastomosis, la pierna biliar en el bucle Roux-en-Y se dividió cerca de la esofagoyejunostomía con un Extrem-Gia de 60mm, cargador marrón, altura media, se ha tenido cuidado de no transcribir el bucle para acercarse a la esofagoyejunostomía, evitando el tejido intestinal desvascularizado entre las dos líneas de grapadora. A continuación, la muestra se insertó en una bolsa y se extrajo a través de un orificio de babor extendido. Finalmente, los orificios de puerto de 12mm se cerraron al nivel de la fascia con sutura reabsorbible. La piel se cerró con grapadora de piel corporal, Appose™ULC (Covidien, Mansfield, MA, EE. UU.).
Postoperatorio Cuidado... A los pacientes se les permitió 300 ml de agua desde el día 0. Desde el día 1 hasta el día 14, a los pacientes se les permitió una dieta fluida. No se utilizaron sonda nasogástrica, catéter de lugar central o catéter epidural. La analgesia se restringió al sistema de administración de fentanilo transcutáneo y paracetamol.
Se realizaron treinta gastrectomías totales laparoscópicas. Además, dos procedimientos se convirtieron en gastrectomía abierta según la indicación de cáncer localmente avanzado que implica una resección de colon y una esplenectomía en un caso ySobre la indicación de márgenes de resección poco claros en el otro caso. Las clasificaciones patológicas de Metástasis en ganglios tumorales (pTNM) se dan en la Tabla II. Es de destacar que un tercio de las resecciones incluyen pacientes con enfermedad en estadio IIb-III. Los resultados perioperatorios de La gastrectomía total laparoscópica se enumeran en la Tabla III y las complicaciones en la Tabla IV.
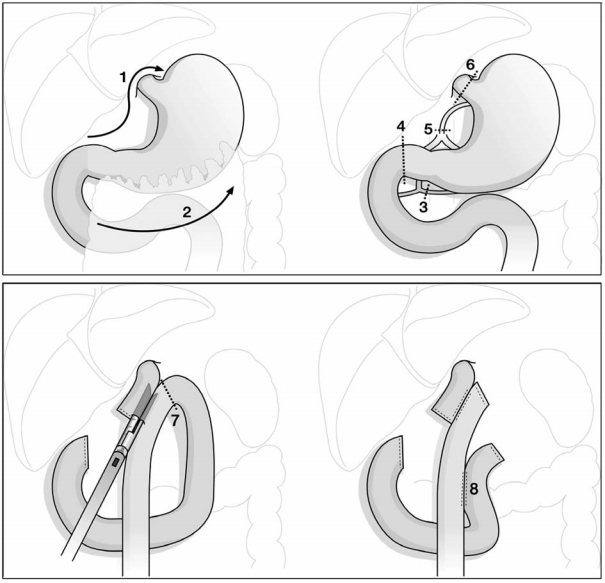
Figura 1.Ilustración De El Operativo Procedimiento: 1:División De El Hepatogástrico Ligamento... 2:Movilización De El Gástrico Mayor Curvatura Dividiendo el Gastrocólico Ligamento Incluyendo El Omento En El Resecado Espécimen... 3:División De El Derecha Gastroepiploico Arteria Y Vena, Cosecha Ganglios linfáticos Estación 5 Y6. 4:División De El Duodenal Bombilla Con Un Lineal Grapadora... 5:División De El Coronal</Em>Vena Y El Izquierda Gástrico Arteria Cierre A El celíaco Maletero,Cosecha Linfa Nodos Conversación8,9Y 11. 6: Resección De El Esófago En El Gastroesofágico Unión En El Esofágico Pausa...
7:Actuación El Esofagoyejunal Anastomosis Lado-A-Lado Con 60Mm Endo-GIA... 8:Actuación El Roux-En-Y Anastomosis Lado-A-Lado Con Un60Mm Endo-GIA Aproximadamente50Cm Desde El Gastroesofágico Anastomosis En El Alimentario Maletero Antes División El Biliar Maletero Solo DebajoEl Gastroyejunal Anastomosis Con Un Endo-GIA.
Había cuatro pacientes con signos radiológicos o clínicos de fuga anastomótica o signos de fuga por el cierre grapado del duodeno. De los tres pacientes con fugas de la anastomosis esofagoyejunal, dos también tenían fugas del bulbo duodenal. Un paciente tuvo una fuga aislada de la línea de resección del bulbo duodenal. Otro paciente fue reoperado pocas horas después de la operación debido a un sangrado de la línea de grapadora en La anastomosis yeyejunal Roux-en-Y y se manipuló con una aplicación asistida por laparoscópica de un clip hemostático. UnoEl paciente fue reoperado una semana después de la operación debido a la hernia del intestino delgado en la pausa esofágica. En total, seis pacientes tuvieron una complicación importante, de los cuales cinco requirieron reoperación. Una complicación importante se trató de forma conservadora con la inserción endoscópica de un stent esofágico acodado para la fuga anastomótica. Los pacientes que adquirieron una complicación mayor también fueron responsables de 75% de Las complicaciones menores registradas.
Cuadro II.Patológico Tumor Nodo Metástasis Clasificación (PTNM) ...
PTNM | Número de pacientes |
PT1N0M0 | 5 |
PT1N1M0 | 1 |
PT2N0M0 | 6 |
PT2N1M0 | 5 |
PT2N2M0 | 3 |
PT2N3M0 | 1 |
PT3N0M0 | 1 |
PT3N1M0 | 1 |
PT3N2M0 | 1 |
PT3N3M0 | 1 |
PT4N1M0 | 1 |
PT4N3M0 | 1 |
Este estudio muestra que la gastrectomía total mínimamente invasiva también se puede realizar para etapas más avanzadas del cáncer gástrico en contraste con la mayoría de los estudios anteriores donde las técnicas mínimamente invasivas se han restringido al cáncer gástrico temprano (tumores T1-T2) en la parte distal del estómago. El enfoque ha sido la resección gástrica distal principalmente mediante una técnica asistida por laparoscópica (2, 9) . La experiencia quirúrgica en el cáncer más avanzado adecuado para la gastrectomía total laparoscópica ha sido limitada, en parte debido al escepticismo y por esto hay varias razones. En Primer lugar debido a la naturaleza biológica de la CA gástricaNcer, donde el número de metástasis de los ganglios linfáticos es importante para la predicción del pronóstico.
El tamaño de la muestra en ensayos clínicos aleatorizados anteriores ha sido pequeño. Aunque el metanálisis de los datos de estos ensayos clínicos aleatorizados se ha publicado en los últimos años la controversia sobre la seguridad en términos de complicaciones, cirugía radical (resección de R0) y la supervivencia a largo plazo todavía existe (3, 4, 6) . Las habilidades necesarias para llevar a cabo el procedimiento laparoscópico, demanda de cirujanos con una experiencia de gran volumen en cirugía laparoscópica. Además, requiere cirujanos con entrenamiento e interés específico en cirugía gástrica laparoscópica e implica una larga curva de aprendizaje (2, 10). Tratar de implementar el procedimiento y adquirir la técnica lleva mucho tiempo en la fase de aprendizaje.
Cuadro III.Laparoscópica Total Gastrectomía:Resultados Son Dado Como Mediana con Rango ...
Pérdida de sangre, ML Número de ganglios linfáticos disección Tiempo de funcionamiento, min Estancia hospitalaria, días | 23 (7-53) 100 (50-650) 180 (120-330) 6 (3-156) |
En los datos preliminares de nuestros primeros 30 procedimientos enGastrectomía total laparoscópica presentada aquí, el número de ganglios linfáticos recuperados en nuestra resección laparoscópica D1 es aceptable y totalmente comparable al de una gastrectomía abierta (3, 11). El Número de ganglios linfáticos obtenidos fue comparable a los datos registrados en el registro nacional danés de cáncer gástrico en relación con la gastrectomía total abierta (7). El tiempo operatorio fue comparable a nuestra experiencia en cirugía abierta. A partir de un metanálisis que investiga a pacientes sometidos a resección de D1 a D2, se espera que el tiempo operatorio se prolongue aproximadamente 60 minutos, al menos, en resecciones distales laparoscópicas que sufren resección de D2 (3) . Sin embargo, el tiempo operatorio fue, en nuestra experiencia, comparable al que se espera de la gastrectomía abierta, aunque esto puede considerarse el inicio de la curva de aprendizaje. Como era de esperar, la pérdida de sangre fue limitada. El uso de un bisturí ultrasónico armónico es crucial para la capacidad de realizar una gastrectomía laparoscópica, aunque la arteria gastroepiploica y la arteria gástrica izquierda se dividieron después de aplicar primero clips vasculares a la base de los vasos. La duración de la estancia hospitalaria Se minimizó en el procedimiento mínimamente invasivo y se estimó que se redujo a la mitad en comparación con la cirugía abierta. Además, la satisfacción del paciente con el procedimiento laparoscópico mínimamente invasivo sin complicaciones fue alta de acuerdo con los estudios clínicos aleatorizados (12). Se produjo una fuga en el bulbo duodenal en dos de los tres pacientes con una fuga de esofagoyejunostomía. Se sabe que una bombilla duodenal con fugas, que es una de las complicaciones más temidas, crea fístulas por contenido duodenal. Esto podría explicar la cicatrización del tejido deteriorado en la esofagoyejunostomía. Sin embargo, también plantea la pregunta sobre la suficiencia de sellar solo el extremo duodenal dividido con una grapadora. En nuestro caso, podría ser necesario coser el duodeno con suturas reabsorbibles interrumpidas. Sufrir una complicación importante trae consigo otras complicaciones, como lo demuestra la alta frecuencia de complicaciones menores en estos datos preliminares.
Elegimos una anastomosis grapada lineal tanto para la esofagojejunostomía como para la enteroanastomosis. Esta técnica tiene varias ventajas sobre la anastomosis grapada circular (13). En primer lugar, crea una anastomosis significativamente más amplia. Además, excluye el problema de un esófago estrecho o la sutura de cuerda de bolsa que a menudo se requiere con anastomosis circular grapada. No tuvimos fugas deLa anastomosis Roux-en-Y, sin embargo, la tasa de fuga de la anastomosis superior fue alta, lo que subraya las dificultades para realizar la anastomosis superior. Se sabe que el esófago tiene un suministro sanguíneo insuficiente y es importante no diseccionar demasiado en el mediastino, lo que desvascularizará la parte distal del esófago.
Cuadro IV...Laparoscópica Total Gastrectomía: Complicaciones Experiencia...
Major, 6 pacientes | Fuga de la anastomosis esofagoyejunal Fuga de bulbo duodenal Sangrado postoperatorio Hernia en hiato esofágico | 3 3 1 1 |
Menor, 8 pacientes | Neumonía Neumotórax Arritmia cardíaca Absceso abdominal | 5 1 4 2 |
La gastrectomía total laparoscópica, que sigue siendo un procedimiento controvertido con respecto a la supervivencia a largo plazo, debe considerarse como un procedimiento de alto riesgo y debe considerarse la seguridad quirúrgica. La gastrectomía total laparoscópica es un procedimiento complejo y exigente. La curva de aprendizaje es larga y el rendimiento del procedimiento requiere que se centralice en centros de alto volumen. La experiencia japonesa sugiere que este procedimiento laparoscópico se beneficiará de un programa de educación formalizado (14).
1 Kitano S, Iso Y, Moriyama M y Sugimachi K: gastrectomía Billroth I asistida por laparoscopia. Endosco de Surg Laparosc4: 146- 148,1994.
2 Kodera Y, Fujiwara M, Ohashi N, Nakayama G, Koike M, Morita S y Nakao A: Cirugía laparoscópica para el cáncer gástrico: Una revisión colectiva con metanálisis de ensayos aleatorizados. J Am Coll Surg211(5): 677-685, 2010.
3 Wei H, Wei B, Qi C, Chen TF, Huang Y, Zheng, Huang JL y Fang JF: LaparoscópicaVersus Gasterctomía abierta con disección de ganglios linfáticos D2 para el cáncer gástrico: un metanálisis. Surg Laparosc Endosc Percutan Tech21: 383-390, 2011.
4 Lee JH, Kim Y, Ryu KW, Lee JR, Kim CG, Choi IJ, Kook MC, Nam BH y Bae JM: un ensayo clínico de Fase II de gastrectomía distal asistida por laparoscopia con disección de ganglios linfáticos D2 para pacientes con cáncer gástrico. Ann Surg Oncol14(11): 3148-3153, 2007.
5 Huscher CG, Mingoli A, Sgarzini G, Sansonetti A, Di Paola M, Recher A y Ponzano C: LaparoscópicoVersus Gastrectomía subtotal abierta para el cáncer gástrico distal: Resultados de cinco años de un ensayo prospectivo aleatorizado. Ann Surg241: 232-237, 2005.
6 Hayashi H, Ochiai T, Shimada H y Gunji Y: Estudio prospectivo aleatorizado de OpenVeRSUs Gastrecomía distal asistida por laparoscopia con disección de ganglios linfáticos extraperitástricos para el cáncer gástrico temprano. Endosco de Surg19: 1172-1176, 2005.
7 DECV. 2011 de las guías clínicas nacionales. http:// gicancer.dk
8 Walther BS, Zilling T, Johnsson F, Stel von Holstein C y Joelsson B: gastrectomía total y esofagoyejunostomía con dispositivos de grapado lineal. Br J Surg76: 909-912, 1989.
9 Zeng YK, Yang ZL, Peng JS, Lin HS y Cai L: asistidos por laparoscopiaVersus Gastrectomía distal abierta para cáncer gástrico temprano evidencia de ensayos clínicos aleatorizados y no aleatorizados. Ann Surg256: 39-52, 2012.
10 Shinohara T, Kanaya S, Taniguchi K, Fujita T, Yanaga K y Uyama I: gastrectomía total laparoscópica con disección de ganglios linfáticos D2 para cáncer gástrico. Arco de seguridad144(12): 1138-1142, 2009.
11 Huscher CG, Mingoli A, Sgarzini G, Sansonetti A, Lirici MM, Napolitano C y Piro F: gastrectomía videolaparoscópica total y subtotal con disección prolongada de ganglios linfáticos para el cáncer gástrico. Am J Surg188(6): 728-735, 2004.
12 Kim YW, Baik YH, Yun YH, Nam BH, Kim DH, Choi IJ y Bae JM: Resultados mejorados de la calidad de vida después de la gastrectomía distal asistida por laparoscopia para el cáncer gástrico temprano: resultados de un ensayo clínico aleatorizado prospectivo. Ann Surg248(5): 721-727, 2008.
13 Walther BS, Oscarson JEA, Graffner HO, Vallgren S y Evander A: Esofagojejunostomía con La grapadora EEE. Cirugía99(5): 598-603, 1986.
14 H-K de Kitano S y Yang: gastrectomía laparoscópica para el cáncer. Springer Verlag, Nueva York, ISBN 978-4-431-54002-1.
Recibido Marzo 5, 2013Revisado Mayo22, 2013Aceptado Mayo 27, 2013
This is the first one.
This is the last one.